
PNU 리서치
- 메인으로 이동
- 연구/산학
- PNU 리서치

융합의과학과 홍창완 교수 연구팀이 CAR-T 세포의 항암 면역반응에서 활성산소(Reactive Oxygen Species, ROS)에 반응하는 Nrf2 전사인자*의 역할을 규명하고, 기존 혈액암뿐만 아니라 고형암에도 적용 가능한 CAR-T 세포 치료기술의 가능성을 확인했다. 혈액암에 대한 면역치료법으로 알려진 ‘CAR-T 세포 치료법’을 전체 암의 90%를 차지하는 고형암에도 효과적으로 적용할 수 있는 길이 열린 것이다.
* 전사인자(transcription factor): 세포 내에서 유전자 발현을 조절하는 단백질.
연구팀은 활성산소에 반응해 항산화 기능을 활성화하는 Nrf2 전사인자가 CAR-T 세포의 암세포 공격 기능을 방해한다는 사실을 밝혀냈다. 기존 CAR-T 세포 치료는 혈액암에서 큰 성과를 거뒀으나, 고형암의 경우 면역억제 환경으로 인해 효과가 제한적이었다. 연구팀은 Nrf2 전사인자를 억제함으로써 항암 면역세포인 CD8+ T 세포와 CAR-T 세포의 활성이 유지되고, 이를 통해 고형암에서도 항암 효과가 크게 향상됨을 확인했다.
CAR-T 세포는 암세포를 공격하도록 특별히 제작된 T 세포다. ‘CAR’는 키메라 항원 수용체(Chimeric Antigen Receptor)의 약자로, CAR-T 세포는 T 세포에 이 수용체를 인공적으로 도입한 것이다. 이 수용체는 암세포를 정확하게 인식하고 공격할 수 있도록 도와주는 역할을 한다.
CAR-T 세포 치료는 환자의 혈액에서 T 세포를 추출해 유전자 조작을 통해 CAR를 도입하고, 이를 다시 환자에게 주입하는 방식으로 이뤄진다. 이렇게 변형된 CAR-T 세포는 암세포를 찾아내 공격할 수 있어 기존의 치료법이 잘 듣지 않는 암에도 효과가 좋은 새로운 면역치료법으로 주목받고 있다.
CAR-T 세포를 이용한 항암 면역치료는 특히 혈액암에서 획기적인 성과를 거두며 암 치료의 새로운 지평을 열었다. 그러나 이 치료법은 전체 암종의 10%에 해당하는 혈액암에만 효과적이라는 한계가 있었다. 나머지 90%를 차지하는 고형암에 대한 CAR-T 세포의 효과를 높이기 위해 많은 연구자들이 노력하고 있지만, 고형암 특유의 면역억제 환경으로 인해 성과를 내기 어려운 상황이었다.
종양미세환경에서 CAR-T 세포의 항암 작용을 방해하는 중요 요소 중 하나가 바로 활성산소다. 활성산소는 세포 대사 과정에서 생성되는 산소 분자로, 적정 수준에서는 세포 신호 전달과 면역반응에 중요한 역할을 하지만, 과도하게 생성되면 암세포의 증식과 전이를 촉진하고 면역세포의 활성을 저해하는 것으로 알려져 있다. 특히, 활성산소에 의한 산화 스트레스는 대표적인 항암 면역세포인 CD8+ T 세포의 활성을 억제해 암 치료의 효능을 저하시킬 수 있다.
또한, 고형암에서는 이러한 활성산소가 과도하게 생성되는데, 이는 면역세포의 기능을 억제하거나 변형시켜 암세포가 면역체계의 공격을 피하게 만든다. 이 때문에 고형암에서 CAR-T 세포의 효과를 높이는 데 어려움이 있는 것이다.
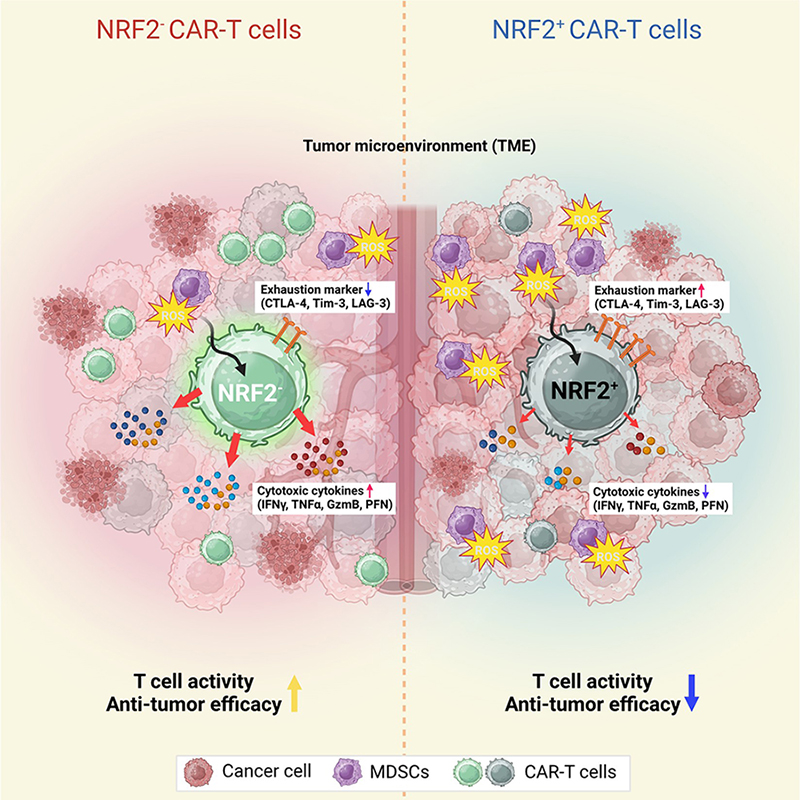
【Nrf2 제어 CAR-T 세포의 항암 면역반응】
고농도 활성산소의 종양미세환경에 노출된 기존의 CAR-T 세포에서 항산화 인자로 알려진 Nrf2가
오히려 세포의 활성을 저해해 최적의 항암 효능을 보이지 못한 반면, Nrf2를 제어한 CAR-T 세포는
고농도 활성산소 환경에서도 정상적으로 강력한 항암 면역반응을 유도했다.
이번 연구에서 홍창완 교수팀은 활성산소에 반응해 항산화 기능을 활성화하는 Nrf2 전사인자가 오히려 CAR-T 세포에서는 활성을 저해해 CAR-T 세포의 종양 살상 기능이 약화된다는 사실을 밝혀냈다.
반대로 Nrf2가 억제되면 고형암의 종양미세환경 내에서 CD8+ T 세포의 활성이 유지됐으며, CAR-T 세포 또한 그 활성이 유지된다는 것을 확인했다. Nrf2 발현 억제를 통한 활성 유지는 CAR-T 세포의 항암 효능을 고형암에서 현저히 향상시키는 결과로 이어졌다.
홍창완 교수는 “이번 연구는 CAR-T 세포 치료의 적용 범위를 혈액암에서 고형암으로 확장하는 데 크게 기여할 수 있는 중요한 성과”라며, “앞으로 Nrf2를 표적으로 하는 CAR-T 세포 치료제가 개발돼 더 많은 암 환자들에게 새로운 희망이 되기를 기대한다”고 밝혔다.
이번 연구는 한국연구재단 중견연구자 지원사업과 네오이뮨텍의 NT4010 산학협력 연구개발사업의 지원을 받아, 부산대 의과대학 홍창완 교수가 교신저자, 조유나 박사가 제1저자, 심주아 박사와 이소민 박사과정생, 서울대 김찬혁 교수가 주요 공동연구자로 수행했다.
항산화 인자(Nrf2)의 항암 반응 억제 기전을 밝힌 이번 연구는 치료제 분야에서 세계적으로 인정받는 『셀(Cell)』 자매지인 『몰리큘라 테라피(Molecular Therapy)』온라인판 8월 22일자로 게재됐다.
- 논문 제목: Targeting ROS-sensing Nrf2 potentiates anti-tumor immunity of intratumoral CD8+ T and CAR-T cells (활성산소 반응 Nrf2 제어가 종양 내 CD8+ T 세포와 CAR-T 세포의 항암 면역반응을 향상시킨다)
- 논문 링크: https://doi.org/10.1016/j.ymthe.2024.08.019

【조유나(왼쪽) 박사가 ‘Cytokines 2024 & KAI 2024’에서 연구 내용을 발표하고 있다】
한편, 이번 연구는 10월 20일부터 23일까지 서울 코엑스에서 개최된 ‘Cytokines(국제사이토카인학회) 2024 & KAI(대한면역학회) 2024’ 학술대회에서 ‘KAI & ICIS Travel Award’를 수상했다. 이 행사는 40여 개국 2,500여 명의 학자들이 한자리에 모여 전 세계 면역학 분야의 최신 연구 성과를 공유하고 토론한 중요 행사였다.
또한, 연구팀의 신기술은 생명공학 회사인 네오이뮨텍으로 기술이전돼, 향후 임상적용 치료제 개발에 활용될 전망이다.
* 상단 사진: 오른쪽부터 홍창완 교수, 조유나 박사
[Abstract]
Cytotoxic T lymphocytes (CTLs) play a crucial role in cancer rejection. However, CTLs encounter dysfunction and exhaustion in the immunosuppressive tumor microenvironment (TME). Although the reactive oxygen species (ROS)-rich TME attenuates the CTL function, the underlying molecular mechanism remains poorly understood. The nuclear factor-erythroid 2-related-2 (Nrf2) is ROS-responsible factor implicated in increasing susceptibility to cancer progression. Therefore, we examined how Nrf2 is involved in anti-tumor responses of CD8+ T and chimeric antigen receptor (CAR)-T cells under ROS-rich TME. Here, we demonstrated that tumor growth in Nrf2-/- mice was significantly controlled and was reversed by T cell depletion and further confirmed that Nrf2 deficiency in T cells promotes anti-tumor responses using adoptive transfer model of antigen-specific CD8+ T cells. Nrf2-deficient CTLs are resistant to ROS, and their effector functions are sustained in TME. Furthermore, Nrf2 knockdown in human CAR-T cells enhanced the survival and function of intratumoral CAR-T cells in solid tumor xenograft model and effectively controlled tumor growth. ROS-sensing Nrf2 inhibits the anti-tumor T cell responses, indicating that Nrf2 may be a potential target for T cell immunotherapy strategies against solid tumors.
* Reference
- Authors (Pusan National University):
· 1st author: Yuna Jo (Department of Anatomy and Department of Convergence Medical Science)
· Corresponding author: Changwan Hong (Department of Anatomy and Department of Convergence Medical Science)
- Title of original paper: Targeting ROS-sensing Nrf2 potentiates anti-tumor immunity of intratumoral CD8+ T and CAR-T cells
- Journal: Molecular Therapy
